服务领域
service


《GMP》对制药企业生产厂房的总体要求
时间:2019-11-26
厂址选择
在条件可能的情况下,尽量选在周转环境较清洁和绿化较好的地区,并尽量远离铁路、公路、机场(尤其是防振要求高的洁净室),与交通干道之间的距离不宜小于50cm。不要选在多风沙的地区和有严重灰尘、烟气、腐蚀性气体污染的工业区。若条件不允许,必须位于工业污染或其它人为灰尘较严重的地区时,要在其全年主导风向的上风侧。
不论是新建或改建的洁净车间周围都要进行绿化,车间四周应设消防车道,厂区的路面尽量选用坚固、起尘少的材料。
工艺布置
在不影响生产情况下,为了减少交叉污染和便于系统布置,尽量将洁净度要求相同的洁净室安排在一起。洁净室内只布置必要的工艺设备,容易产生灰尘和有害气体的工艺设备或辅机尽量布置在洁净室的外部。在同一洁净室内,尽量将洁净度要求高的工序布置在洁净气流首先到达的区域,容易产生污染的工序布置在靠近回、排风口的位置。
建筑要求
洁净室的位置要尽量设在人流少的地方,人流方向要由低洁净度的洁净室向高一级的洁净室过渡,在洁净室内一般采用上送下回方式。
上送上回方式虽然在某些空态测定中可能达到设计洁净度级别,但在动态时很不利于排除污染,所以是不宜推荐的方式,这是因为:
(1)上送上回容易形成某一高度上某一区域气流趋向停滞,当使微粒的上升力和重力相抵时,易使大微粒(主要是5μm微粒)停留在某一空间区域,所以不利于排除尘粒和保证工作区工作风速(对于局部百级);
(2)容易造成气流短路,使一部洁净气流和新风不能参与全室的作用,因而降低了洁净效果和卫生效果;
(3)容易使污染微粒在上升排出过程中污染其经过的操作点,在洁净走廊由于没有操作点,如用上回则一般不存在这种危险,在其两边房间之间没有特别的交叉污染的条件下,采用上送上回方式是可以允许的——仅指30万级的低要求洁净室采用。
药品生产企业的厂房与设施是指制剂、原料药、药用辅料和直接接角药品的药用包装材料生产中所需的建筑物以及与工艺配套的公用工程。
药品生产企业为了消除混药和污染,或将这种可能性降至最低,必须要有整洁的生产环境及与所生产医药用品相适应的厂房设施,这包括规范标准化厂房以及相配套的净化空气处理系统、照明、通风、水、气体、洗涤与卫生设施、安全设施等。这里讲的制药生产企业的厂房与设施就是指药品生产所需的环境保证条件。
因为厂房与设施是药品生产的根本条件,是实现《GMP》的“硬件”,WHO及各国的GMP中均有厂房设施专门的章节;我国的《GMP》1999年修订版亦对厂房与设施条件做了具体要求。
药品生产企业为了防止来自各种渠道的污染,采取了 多方面的污染控制措施。普遍采用洁净技术,并初步形成了综合性的洁净技术体系作为洁净室的主要组成部分。空气净化是极为重要的,它与洁净室的建筑设计有着极为密切的相互依存关系。纯水及高纯工业气体也是经常遇到,它们虽各有其可以安置在洁净厂房外的独立制备工艺,但往往由于生产中的种种特定条件,其使用点一般均在洁净室内。
美国宇航标准中的洁净度级别表 表一
级别 | 微粒 | 生物微粒 | |||||
粒径 | 最大数量 | 浮游最大数量 | 沉降量 | ||||
(μm) | (粒/ft3) | (粒/L) | (粒/ft3) | (粒/L) | (粒/ft3·周) | (粒/ | |
100 | 100 | 3.5 | 0.1 | 0.0035 | 1200 | 12900 | |
10000 | ≥0.5 | 10000 | 350 | 0.5 | 0.0176 | 6000 | 64600 |
≥0.5 | 65 | 2.5 | |||||
100000 | ≥0.5 | 100000 | 3500 | 2.5 | 0.0884 | 30000 | 323000 |
≥0.5 | 700 | 25 | |||||
1978年国际空气洁净度标准(草案) 表二
级 别 | 空气中生物和非生物微粒总数≥0.5μm微粒的最大数量 | 空气中生物微粒单位容积空气中活性菌落最大数量 | 表面生物微粒沉降菌落最大数量 | |||
(ft3) | (L) | (ft3) | (L) | (粒/ft2·d) | (粒/m2·周) | |
1 | 不控制 | 不控制 | 不控制 | |||
2 | 100000 | 3500 | 2.5 | 0.0884 | 200 | 323000 |
3 | 10000 | 350 | 0.5 | 0.0176 | 40 | 64600 |
4 | 100 | 3.5 | 0.1 | 0.0035 | 8 | 12900 |
5 | 10 | 0.35 | 0.04 | 0.0014 | 3 | 5200 |
美国联邦标准从209C开始一直到209E都明确提出空气洁净度级别和生物微粒之间还没有建立起确定的关系,都没有给出和微粒总数相对应的生物微粒数量的规定。由于生产的需要,从209C开始出了比100级更高的级别——0.5μm10级、1级或者0.1μm 10级、1级。
美国联邦标准209E 表三
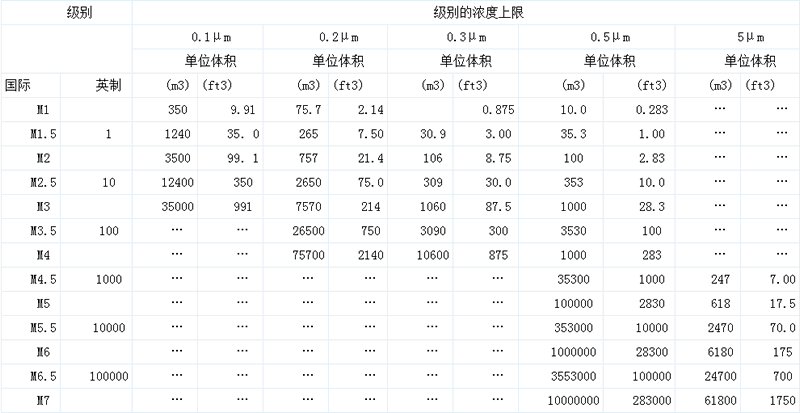
关于工业用洁净室方面的指南、规定、标准参考资料、解说和实际用例,我国过去已经发表介绍了许多。空气中的悬浮尘埃的控制技术,70年代初期在我国药品生产企业运用中还是先进技术,而现在已从一般尘埃的控制转变到生物微粒的控制。目前在生物净化的名义下,正以医院为中心,向着新的领域继续发展,形成了生物洁净技术。
在药品生产企业洁净室的发展过程中,1950年高效过滤器的研制,1962年层流(现在称单向流)概念在洁净室方面的应用以及1963年美国联邦标准209的发表,都是很大的技术革新。若没有高效过滤器的发展,便无法以用0.5um悬浮尘粒来规定空气洁净度(附表三)。
水与工业气体在药品生产上都普遍使用,它们或者与产品多次接触,或者直接参与产品的化学、物理过程,它们的纯净程度往往要比空气洁净程度对于产品质量有更加直接的影响。
上一篇:制药工业要求的室内环境计算参数
下一篇:GMP洁净厂房设计要求与计算公式